Wegovy® arriva anche in Italia

Semaglutide, farmaco noto per i suoi benefici sul peso, in realtà al momento in Italia è approvato SOLO per il diabete di tipo 2, nonostante le molteplici assunzioni a scopo dimagrante, frutto di polemiche e di prescrizioni fuori scheda tecnica.
Da questa estate tuttavia sarà disponibile anche nelle nostre farmacie in una “nuova” veste, approvata direttamente per il trattamento dell’obesità.
Semaglutide “vecchio” e “nuovo”: che cosa cambia
In realtà i pazienti con diabete e quelli con obesità assumeranno comunque la stessa molecola, il principio attivo è infatti identico!
Ciò che cambia, oltre al nome commerciale (Ozempic® e Rybelsus® per diabete, Wegovy® per obesità), è l’indicazione da scheda tecnica (Wegovy® sarà approvato direttamente per l’obesità) e il dosaggio massimo (1 mg per il diabete e 2.4 mg per l’obesità).
La somministrazione sarà sempre settimanale e sottocutanea con penne pre-riempite. Per ridurre la probabilità di insorgenza di sintomi gastrointestinali, è necessario aumentare la dose nell’arco di un periodo di 16 settimane fino a una dose di mantenimento di 2,4 mg una volta alla settimana. Il dosaggio sarà 0.25 mg ➔ 0.5 mg ➔ 1 mg ➔ 1.7 mg ➔ 2.4 mg.

Visto che il dosaggio massimo è più del doppio di quello utilizzato per il diabete, i risultati attesi per la perdita di peso sono ancora più importanti.
Effetti e risultati
Negli adulti con obesità o sovrappeso con almeno una comorbidità correlata al peso, insieme a dieta ed esercizio fisico, Wegovy® ha prodotto una perdita di peso significativa e sostenuta a 2 anni nel 77% dei pazienti (perdita di peso media del 15%). Circa 1 paziente su 3 ha ottenuto una perdita di peso superiore al 20% (circa 21 kg con peso di partenza medio di 105 kg).
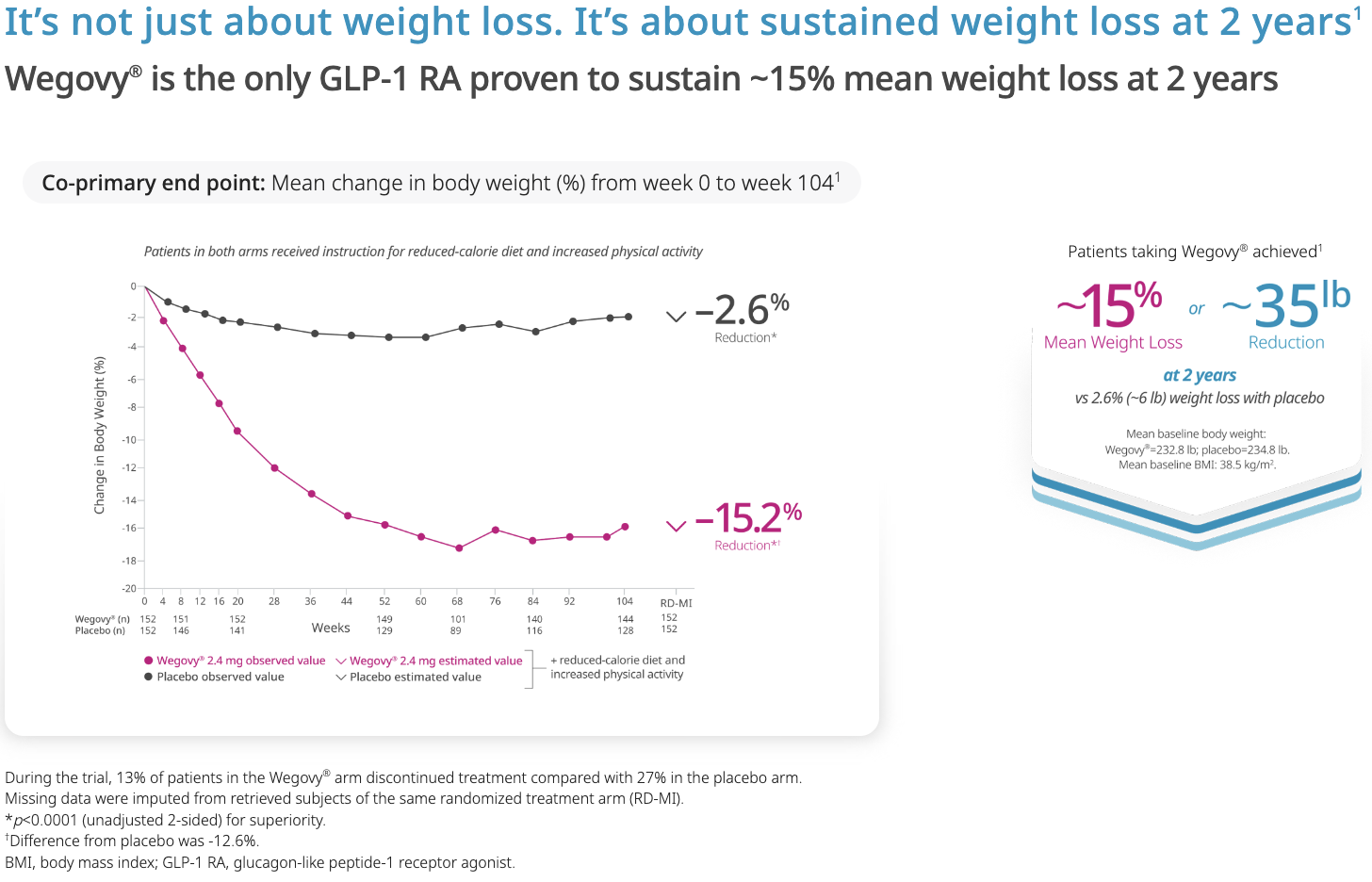

È stato inoltre che riduce il rischio relativo di (eventi cardio-vascolari maggiori) MACE del 20%; con riduzione media di LDL del 5.3%, dei trigliceridi del 18.3%, della pressione arteriosa sistolica di 3.8 mmHg.
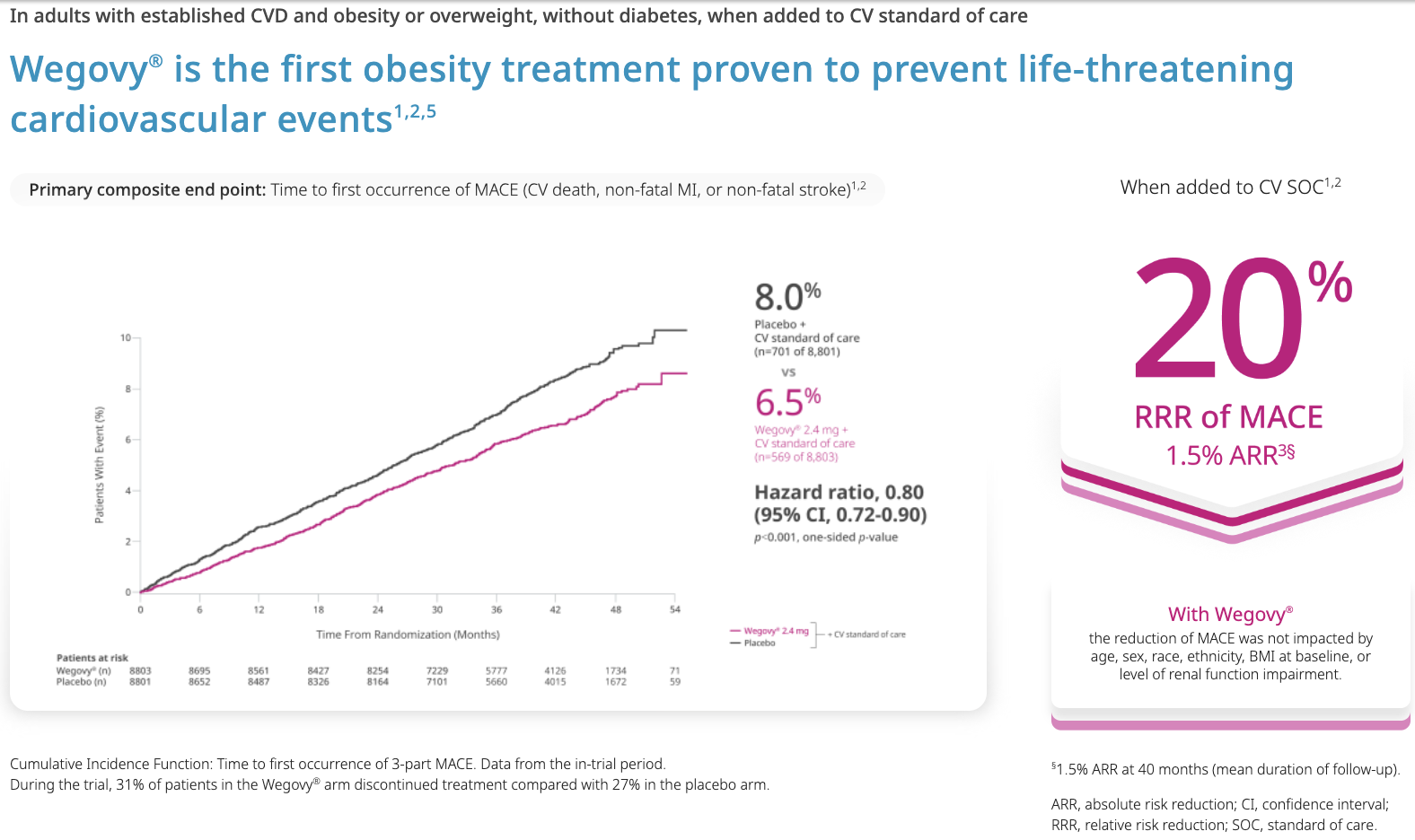

Il trattamento prolungato con semaglutide di pazienti non affetti da DM2 con obesità di primo grado e malattia CV nota, produce una riduzione della mortalità per cause CV, di infarto e di ictus non fatali, oltre che una significativa riduzione del peso che si mantiene nel tempo. Questi dati ci dicono che non trattare l’obesità di questi pazienti si traduce anche in un aumento della mortalità; aggiungono un importante tassello nella pratica clinica e devono servire e ridurre l’inerzia terapeutica spesso presente nei confronti dei pazienti con obesità.
Infine gli studi più recenti indicano un beneficio di semaglutide anche sulla funzionalità renale. Tasso di declino annuale di filtrazione renale: -1.16 mL/min/1.73 m2/anno. Semaglutide da 1 mg riduce del 24% il rischio di progressione della malattia renale cronica in pazienti con diabete di tipo 2.
Come funziona
Semaglutide stimola l’ormone GLP-1 (peptide 1 simile a glucagone), che ha recettori presenti nelle cellule endocrine α e β del pancreas, nel cuore, nel sistema vascolare, nelle cellule immunitarie (leucociti), nell’intestino e nei reni. Tale ormone riduce le glicemie promuovendo la produzione insulinica e al contempo aiuta a perdere peso rallentando lo svuotamento gastrico e agendo sul senso di sazietà. Inoltre sono sempre di più gli studi che evidenziano la protezione cardio-vascolare, e soprattutto cerebro-vascolare, donata da questo farmaco.
Nonostante non siano pienamente compresi i meccanismi attraverso cui la perdita di peso determini una riduzione del rischio CV, numerose sono le ipotesi considerate:
- riduzione del tessuto adiposo ectopico;
- miglioramento dello stato sistemico pro-infiammatorio e pro-trombotico;
- conseguente riduzione di disfunzione miocardica e aterosclerosi.
Indicazioni
È indicato in aggiunta a una dieta ipocalorica e a un aumento dell’attività fisica per la gestione del peso, compresi la perdita di peso e il mantenimento del peso, in adulti con un indice di massa corporea (BMI):
- nell’adulto: ≥30 kg/m2 (obesità), o da ≥27 kg/m2 a <30 kg/m2 (sovrappeso) in presenza di almeno una comorbilità correlata al peso, ad es. disglicemia (pre-diabete o diabete mellito di tipo 2), ipertensione, dislipidemia, apnea ostruttiva del sonno o malattia cardiovascolare.
- in età pediatrica: età ≥ 12 anni con peso ≥ 60 kg e con BMI iniziale ≥ 95° percentile per età e sesso
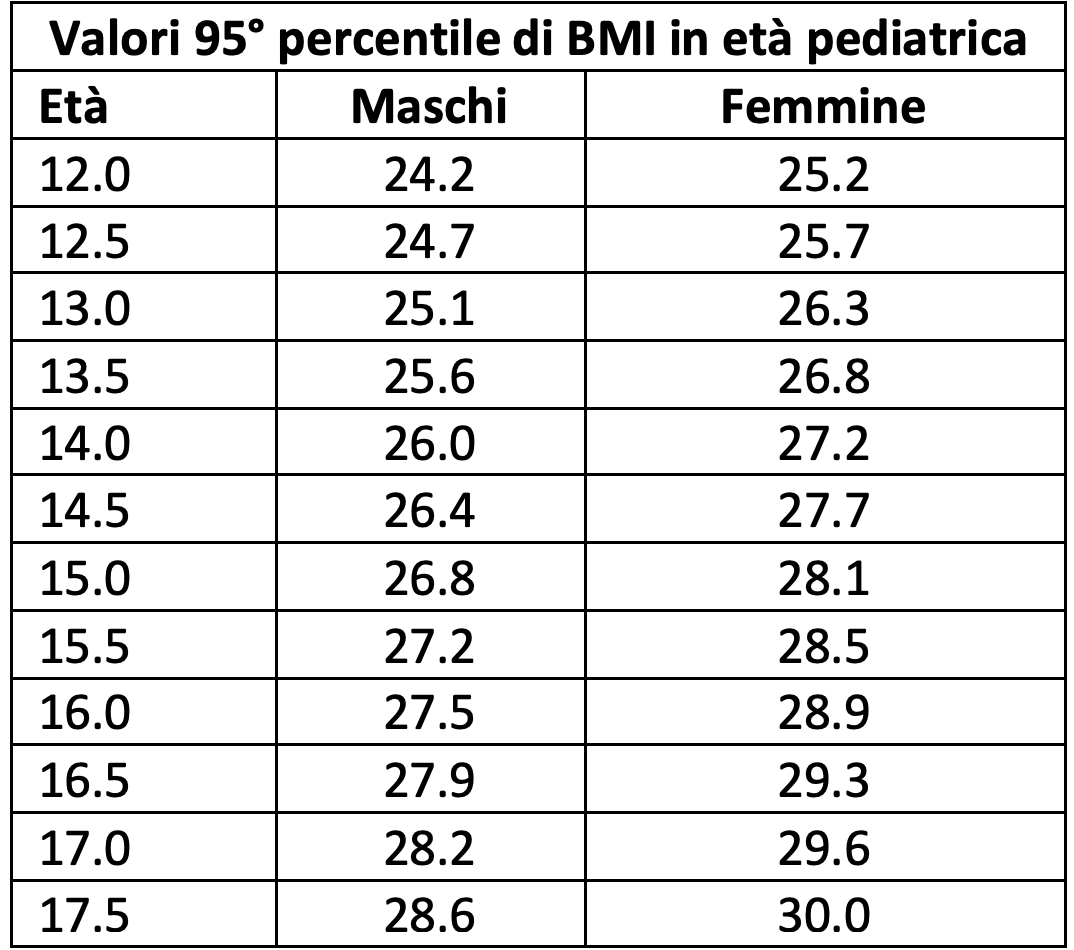
Aspetti pratici
Siti di somministrazione sottocutanea: addome, coscia, braccio.
È possibile somministrarla in orari diversi e in siti diversi, indipendentemente dai pasti.
Cosa fare se il paziente dimentica la somministrazione?
- di una dose e mancano più di 48 ore alla dose successiva programmata: somministrare la dose dimenticata il prima possibile;
- di una dose e mancano meno di 48 ore alla dose successiva programmata: non somministrare la dose e riprendere la somministrazione nel giorno della settimana regolarmente programmato;
- di due dosi consecutive: si consiglia di riprendere direttamente la somministrazione come previsto, oppure scalare la dose per evitare la comparsa di effetti gastro-intestinali (eventualmente tornare anche alla dose iniziale e riprendere la titolazione del farmaco).
Effetti avversi
Le reazioni avverse più comuni (incidenza ≥ 5%) sono: nausea, diarrea, vomito, costipazione, dolore addominale, mal di testa, astenia (stanchezza), dispepsia, vertigini, distensione addominale, eruttazione, ipoglicemia in pazienti con diabete di tipo 2, flatulenza, gastroenterite, reflusso gastroesofageo e nasofaringite.
Avvertenze e precauzioni
- Pancreatite acuta: pancreatite acuta, inclusa pancreatite emorragica o necrotizzante fatale e non fatale, è stata osservata in pazienti trattati con agonisti del recettore del GLP-1, incluso semaglutide. Se si sospetta una pancreatite acuta, interrompere immediatamente Wegovy® e, se la pancreatite acuta viene confermata, non riprendere.
- Malattia acuta della colecisti: il trattamento con Wegovy® è associato ad un aumento dell’incidenza di colelitiasi e colecistite. L’incidenza di colelitiasi e colecistite è stata maggiore nei pazienti pediatrici Wegovy® di età pari o superiore a 12 anni rispetto agli adulti. Negli studi clinici condotti su pazienti adulti, la colelitiasi è stata segnalata nell’1,6% dei pazienti trattati con Wegovy® e nello 0,7% dei pazienti trattati con placebo. La colecistite è stata segnalata dallo 0,6% dei pazienti Wegovy® e dallo 0,2% dei pazienti trattati con placebo. In uno studio clinico condotto su pazienti pediatrici di età pari o superiore a 12 anni, la colelitiasi è stata segnalata nel 3,8% dei pazienti Wegovy ® e nello 0% dei pazienti trattati con placebo. La colecistite è stata segnalata dallo 0,8% dei pazienti pediatrici Wegovy® e dallo 0% dei pazienti trattati con placebo. Una perdita di peso sostanziale o rapida può aumentare il rischio di colelitiasi; tuttavia, l’incidenza della malattia acuta della colecisti è stata maggiore nei pazienti trattati con Wegovy® rispetto ai pazienti trattati con placebo, anche tenendo conto del grado di perdita di peso. Se si sospetta una colelitiasi, sono indicati studi sulla colecisti e un appropriato follow-up clinico.
- Ipoglicemia: Wegovy® abbassa la glicemia e può causare ipoglicemia. In uno studio su pazienti adulti con diabete di tipo 2, l’ipoglicemia è stata segnalata nel 6,2% dei pazienti trattati con Wegovy® rispetto al 2,5% dei pazienti trattati con placebo. I pazienti con diabete che assumono Wegovy® con un’insulina o un secretagogo dell’insulina (ad esempio una sulfonilurea) possono avere un aumento del rischio di ipoglicemia, inclusa un’ipoglicemia grave. L’uso di Wegovy® in pazienti con diabete di tipo 1 o in combinazione con insulina non è stato valutato, pertanto è controindicato. Informare i pazienti del rischio di ipoglicemia ed educarli sui segni e sintomi. Monitorare la glicemia nei pazienti con diabete.
- Danno renale acuto: sono stati segnalati casi post-marketing di danno renale acuto e peggioramento dell’insufficienza renale cronica, che in alcuni casi ha richiesto emodialisi, in pazienti trattati con semaglutide. I pazienti con insufficienza renale possono essere maggiormente a rischio di danno renale acuto, ma alcuni eventi sono stati segnalati in pazienti senza malattia renale di base nota. La maggior parte degli eventi si è verificata in pazienti che hanno manifestato nausea, vomito o diarrea, con conseguente deplezione di volume. Monitorare la funzionalità renale quando si iniziano o si aumentano le dosi di Wegovy® in pazienti che segnalano gravi reazioni avverse gastrointestinali e in pazienti con compromissione renale che segnalano qualsiasi reazione avversa che potrebbe portare a deplezione di volume.
- Reazioni di ipersensibilità: con Wegovy® sono state segnalate gravi reazioni di ipersensibilità (ad es. anafilassi, angioedema) . Se si verificano reazioni di ipersensibilità, interrompere l’uso di Wegovy®, trattare tempestivamente secondo lo standard di cura e monitorare fino alla risoluzione dei segni e dei sintomi. Usare cautela in un paziente con una storia di anafilassi o angioedema con un altro agonista del recettore GLP-1.
- Complicanze della retinopatia diabetica in pazienti con diabete di tipo 2: in uno studio condotto su pazienti adulti con diabete di tipo 2, la retinopatia diabetica è stata segnalata dal 4,0% dei pazienti Wegovy® e dal 2,7% dei pazienti trattati con placebo. Un rapido miglioramento del controllo glicemico è stato associato ad un temporaneo peggioramento della retinopatia diabetica. I pazienti con una storia di retinopatia diabetica devono essere monitorati per la progressione della retinopatia diabetica.
- Aumento della frequenza cardiaca: negli studi clinici sono stati osservati aumenti medi della frequenza cardiaca a riposo da 1 a 4 battiti al minuto (bpm) nei pazienti adulti Wegovy® rispetto al placebo. Un numero maggiore di pazienti adulti trattati con Wegovy® rispetto al placebo ha avuto variazioni massime dal basale da 10 a 19 bpm (41% contro 34%) e 20 bpm o più (26% contro 16%). In uno studio clinico condotto su pazienti pediatrici di età pari o superiore a 12 anni con frequenza cardiaca basale normale, un numero maggiore di pazienti trattati con Wegovy® rispetto al placebo ha avuto variazioni massime della frequenza cardiaca di 20 bpm o più (54% contro 39%). Monitorare la frequenza cardiaca a intervalli regolari e chiedere ai pazienti di riferire palpitazioni o sensazione di battito cardiaco accelerato mentre sono a riposo. Se i pazienti riscontrano un aumento prolungato della frequenza cardiaca a riposo, interrompere Wegovy®.
- Rischio di tumori a cellule C della tiroide: i pazienti devono essere ulteriormente valutati se la calcitonina sierica risulta elevata o se si notano noduli tiroidei all’esame obiettivo o all’imaging del collo. Nei roditori, semaglutide causa tumori delle cellule C della tiroide dipendenti dalla dose e dalla durata del trattamento a esposizioni clinicamente rilevanti. Non è noto se Wegovy® causi tumori a cellule C della tiroide, compreso il carcinoma midollare della tiroide (MTC), nell’uomo poiché la rilevanza umana dei tumori a cellule C della tiroide nei roditori indotti da semaglutide non è stata determinata. Wegovy® è controindicato nei pazienti con una storia personale o familiare di MTC o nei pazienti con sindrome da neoplasia endocrina multipla di tipo 2 (MEN 2). Il monitoraggio di routine della calcitonina sierica o l’uso dell’ecografia tiroidea hanno un valore incerto per la diagnosi precoce dell’MTC nei pazienti trattati con Wegovy®.
- Comportamento e ideazione suicidaria: comportamento e ideazione suicidaria sono stati segnalati negli studi clinici con altri prodotti per il controllo del peso. Monitorare i pazienti per depressione, pensieri o comportamenti suicidari e/o eventuali cambiamenti insoliti dell’umore o del comportamento. Interrompere Wegovy® nei pazienti che manifestano pensieri o comportamenti suicidari ed evitare nei pazienti con una storia di tentativi di suicidio o idea suicidaria attiva. Dopo aver esaminato le prove disponibili derivanti da studi non clinici, sperimentazioni cliniche, dati di sorveglianza post-marketing e studi disponibili, il comitato PRAC dell’EMA ha annunciato che Non ci sono prove che colleghino il diabete e i farmaci dimagranti come Ozempic e Wegovy a un aumento dei pensieri suicidari o autolesionismo (https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-8-11-april-2024)
In conclusione
Semaglutide si sta confermando uno dei farmaci più importanti del XXI secolo, con un larghissimo ed assai positivo impatto sui parametri glico-metabolici e cardio-vascolari. E’ in atto una vera e propria rivoluzione nel trattamento farmacologico dell’obesità e semaglutide ne è fra i protagonisti. Tuttavia semaglutide non è un farmaco miracoloso ma un prezioso alleato che, quando necessario, deve entrare all’interno di un programma completo di gestione del peso e dimagrimento duraturo che comprende di solito anche altri step, in primis dieta ed attività fisica.
Wegovy® è un farmaco soggetto a prescrizione medica e non può essere acquistato direttamente dai pazienti senza una prescrizione valida. Il suo acquisto da fonti non autorizzate o online è illegale e può essere pericoloso, poichè si possono ricevere prodotti contraffatti e senza alcuna garanzia di qualità del principio attivo e dei suoi eccipienti. Inoltre assumere Wegovy® senza la supervisione dello specialista può vanificare i risultati della terapia.
🆘 Desideri supporto medico riguardo a questo argomento? Soffri o sospetti di soffrire di patologie simili? 👉🏻 Prenota una visita endocrinologica 👈🏻
FONTI
- Wegovy – scheda tecnica – Agenzia Italiana del Farmaco
- Rubino D, Abrahamsson N, Davies M, et al. Effect of continued weekly subcutaneous semaglutide vs placebo on weight loss maintenance in adults with overweight or obesity: the STEP 4 randomized clinical trial. JAMA. 2021;325(14):1414-1425.
- Wilding JPH, Batterham RL, Calanna S, et al. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med. 2021;384(11):989-1002.
- Rubino DM, Greenway FL, Khalid U, et al. Effect of weekly subcutaneous semaglutide vs daily liraglutide on body weight in adults with overweight or obesity without diabetes: the STEP 8 randomized clinical trial. JAMA. 2022;327(2):138-150.
- Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. N Engl J Med. 2023;389(24):2221-2232.
- Semaglutide Effects on Heart Disease and Stroke in Patients With Overweight or Obesity (SELECT). ClinicalTrials.gov identifier: NCT03574597. Updated February 14, 2024. Accessed March 6, 2024
- FDA approves first treatment to reduce risk of serious heart problems specifically in adults with obesity or overweight. FDA. Published March 8, 2024. Accessed March 22, 2024. https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-reduce-risk-serious-heart-problems-specifically-adults-obesity-or
- Perkovic V, Tuttle KR, Rossing P, et al; FLOW trial committees and investigators. Effects of semaglutide on chronic kidney disease in patients with type 2 diabetes. N Engl J Med 2024, DOI: 10.1056/NEJMoa2403347.
- https://www.wegovy.com/
- https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-8-11-april-2024
Lascia un commento