In collaborazione con il dott. Giovanni Rossini, medico chirurgo specialista in endocrinologia e malattie del metabolismo

I noduli tiroidei sono comuni (nell’adulto arrivano fino al 50% nelle donne e al 30% negli uomini). Anche se la maggior parte di questi è benigna e non cresce eccessivamente nel tempo, circa il 10% ha invece un accrescimento costante e può richiedere un trattamento per sintomi locali (difficoltà a deglutire, respirare, parlare…) o problemi estetici.
Il trattamento più utilizzato è la chirurgia tiroidea, con rimozione di una parte o della totalità della tiroide. Questo intervento però, per quanto sicuro se effettuato da chirurghi esperti, non è privo di complicanze e richiede terapia a vita con ormone tiroideo.
Termoablazione
Un’alternativa alla chirurgia che sta prendendo sempre più piede negli ultimi anni è la termoablazione sotto guida ecografica, che utilizza diverse fonti di energia (laser, radio-frequenza, micro-onde e ultrasuoni focalizzati). Queste tecniche riducono significativamente il volume del nodulo, migliorando i sintomi ed evitando che il paziente si sottoponga alla chirurgia, con un ritorno più veloce alla quotidianità.
Con la termoablazione si genera un danno termico irreversibile al tessuto bersaglio, utilizzando differenti sorgenti di energia che aumentano la temperatura nella zona circoscritta del nodulo, “bruciandolo” e riducendone così le dimensioni.
| Temperatura (°C) | Effetto cellulare |
| <40 | No danno significativo |
| 40 – 45 | Danno cellulare reversibile |
| 46 – 60 | Denaturazione |
| 61 – 100 | Necrosi coagulativa |
| 101 - 200 | Essiccazione |
Indicazioni
Le tecniche termoablative sono utilizzate principalmente nella gestione dei noduli tiroidei BENIGNI sintomatici. Il particolare le indicazioni principali alla temroablazione sono:
- noduli clinicamente rivelanti (es >3 cm), in presenza di:
- sintomi compressivi e/o problemi cosmetici
- accresscimento progressivo
- noduli iperfunzionanti in pazienti con controindicazioni o rifiuto a chirurgia e/o radioiodio

La presenza di sintomi compressivi o problematiche estetiche costituisce l’indicazione al trattamento, poichè noduli di dimensioni simili possono causare sintomi variabili in pazienti diversi, in rapporto a:
- indice di massa corporea (BMI)
- circonferenza del collo
- localizzazione del nodulo (es. zona mediana – istmo)
- suscettibilità individuale
Le linee guida coreane del 2017 (Kim JH, Baek JH, Lim HK, et al. 2017 Thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol 2018, 19: 632-55) suggeriscono la termoablazione in quei noduli che hanno un diametro maggiore di almeno 20-30 mm. Al contrario, non c’è un diametro massimo concordato, anche se più grandi sono le dimensioni del nodulo, maggiore è la probabilità che serviranno ulteriori trattamenti nel tempo. La procedura può essere considerata anche in noduli di dimensioni > 20 mm che continuano a crescere in modo costante, prevenendo la comparsa dei sintomi compressivi e delle problematiche estetiche.
Nel tentativo di standardizzare sintomi e disturbi estetici, le stesse linee guida coreane hanno considerato dei punteggi:
- il punteggio sintomatico può essere stabilito dal paziente, usando una scala visiva analogica (VAS), che va da 0 (nessun sintomo) a 10 (sintomi massimi);
- il punteggio estetico viene invece stabilito dal medico
| 1. Massa non palpabile |
| 2. Massa palpabile senza problema estetico |
| 3. Problema estetico evidente solo con la deglutizione |
| 4. Evidente problema estetico |
L’European Thyroid Association (ETA) ha formulato nel 2020 le raccomandazioni per la termo-ablazione del nodulo tiroideo benigno.

Per quanto concerne la patologia nodulare MALIGNA ad oggi la termoablazione è indicata nel trattamento di casi selezionati di micro-carcinomi (<1 cm, che potrebbe anche essere seguito solo con la sorveglianza attiva), utilizzando soprattutto al tecnica laser.
La valutazione pre-procedurale del paziente deve includere la dimostrazione della benignità del nodulo, con due successivi esami citologici su agoaspirato. Nel caso di noduli con chiare caratteristiche di benignità – come quelli interamente cistici o spongiformi e i noduli iperfunzionanti – è sufficiente un solo agoaspirato con risultato benigno. La più recente Consensus internazionale prevede che l’agoaspirato possa essere risparmiato nei noduli funzionalmente autonomi.
| Clinica | Punteggio sintomatico ed estetico |
| Ecografia | Ecocolor-doppler tiroideo |
| Laboratorio | Emocromo Profilo coagulativo Funzione tiroidea |
| Citologia | Di regola > 2 esami citologici con risultato di benignità. Se lesione con caratteristiche altamente suggestive di benignità o nodulo funzionalmente autonomo > 1 esame citologico |
| Valutazione otorino-laringoiatrica | Laringoscopia raccomandata se precedente chirurgia cervicale o anomalie fonatorie |
| TC/RM | In casi selezionati |
| Scintigrafia | Se sospetto di nodulo iperfunzionante |
Se il paziente assume terapia anti-aggregante o anti-coagulante è necessario interromperla prima della procedura. Nei giorni di sospensione della terapia orale, può essere presa in considerazione una terapia con eparina. In assenza di complicanze, la terapia anti-coagulante può essere ripresa entro 24 ore dalla procedura.
| CATEGORIA | SOSPENSIONE PRIMA DELLA PROCEDURA (GIORNI) |
| Anti-aggreganti (ASA, clopidogrel) | 7-10 |
| Warfarin | 5 |
| NAO (apixaban, dabigatran, endoxaban, rivaroxaban) | 1-2 |
Ecografia tiroidea
L’ecocolor-doppler della tiroide svolge un ruolo fondamentale nella valutazione pre-trattamento. Serve per valutare il volume iniziale del nodulo (per un trattamento efficace è consigliabile che non superi i 30 mL, sebbene operatori esperti possano trattare noduli fino a 100 mL) e fornisce il riferimento per il follow-up. La valutazione della vascolarizzazione è utile per alcune azioni tecniche, come l’ablazione del ramo arterioso principale, quando ben visibile, e della vene marginali peri-nodulari per interrompere l’apporto sanguigno al nodulo e ridurne la probabilità di ricrescita nel tempo. È fondamentale valutare un’adeguata distanza fra la zona da trattare ed il solco tracheo-esofageo o la zona critica dove decorre il nervo laringeo ricorrente (“triangolo pericoloso”). Inoltre, è necessario individuare la vena giugulare anteriore, principale causa di ematomi se danneggiata, il nervo vago e la catena simpatica. Queste informazioni consentono di pianificare e condurre la procedura in modo sicuro ed efficace.

Vediamo ora le tecniche principali
Laser (LTA)
Si raggiunge il nodulo con un ago, all’interno del quale si infila una fibra ottica che attraverso un raggio laser di luce monocromatica genera calore nel tessuto bersaglio.
Per raggiungere il tessuto nodulare, vengono utilizzati aghi mandrinati di calibro 21G, all’interno dei quali, dopo aver rimosso il mandrino, viene inserita una fibra ottica del diametro di 300 micron. Attualmente si utilizzano generalmente sorgenti come ittrio-alluminio e neodimio, operanti a 1064 nm, oppure laser a diodi che operano a 820 nm. Rispetto alle altre tecniche, l’energia erogata è inferiore (2-4 W), il che assicura maggiore precisione. Di solito, si inseriscono due fibre ottiche per amplificare l’area ablativa, utilizzando due possibili approcci, trans-istmico o longitudinale. Gli applicatori vengono posizionati sullo stesso piano e distanziati di 8 mm per garantire un controllo sincrono delle fibre. L’ablazione inizia dalle zone più remote del nodulo rispetto al punto di ingresso della fibra ottica, ed è possibile completare l’ablazione grazie a un movimento di retrazione delle fibre (“pull-back”), coinvolgendo in sequenza le aree prossimali. Le alterazioni tissutali indotte dal calore liberano bolle gassose che vengono rilevate dalla sonda ecografica come segnali iperecogeni. Il costo medio di un generatore laser è di circa € 30.000, mentre il costo del materiale mono-uso (fibra ottica e ago introduttore) varia da 300 a 500 €.


Radio-frequenza (RFA)
Si inserisce nel nodulo un ago-elettrodo che viene riscaldato grazie ad una corrente elettrica alternata – con frequenza tra 200 e 1200 kHz. L’ago-elettrodo è raffreddato internamente e ciò protegge il tessuto sano circostante e agevola la diffusione del calore, riducendo l’impedenza del tessuto. La corrente alternata genera un movimento di ioni all’interno del tessuto che, seguendo il flusso alternato, produce calore per attrito. Il rapido innalzamento dei valori impedenziometrici segnala la necrosi del tessuto trattato.
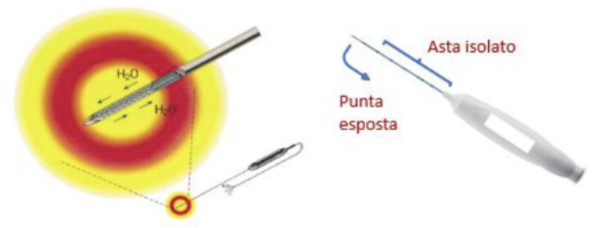
Il circuito elettrico è formato da:
- ago-elettrodo
- generatore di corrente alternata
- piastre di messa a terra, posizionate su entrambe le cosce del paziente, che servono a chiudere il circuito elettrico.
I portatori di pace-maker e le donne in gravidanza non sono pertanto candidabili a questa procedura. La discrepanza tra la piccola superficie dell’ago e l’ampia area delle piastre di messa a terra fa sì che il calore generato sia concentrato attorno all’agoelettrodo. Una pompa peristaltica spinge la soluzione salina fredda nell’ago per raffreddarlo, quindi l’acqua riscaldata viene scaricata. La tecnica moving shot utilizza sempre un approccio trans-istmico. Il nodulo viene idealmente suddiviso in multiple piccole subunità (“unità di ablazione”) e l’ago – inizialmente posizionato nell’unità più profonda e posteriore del nodulo – viene progressivamente retratto fino alle porzioni più superficiali. Il costo medio di un generatore di onde di radio-frequenza varia da 20.000 a 35.000 €, mentre il costo del materiale mono-uso (ago-elettrodo) varia da 700 a 1200 €.

Micro-onde (MWA)
Si inserisce nel nodulo un ago, definito antenna, che emettendo micro-onde induce la rotazione delle molecole di acqua contenute nei tessuti e quindi genera calore – lo stesso principio con cui riscaldiamo gli alimenti. Questa tecnica di ablazione si basa su un campo magnetico generato attorno al segmento radiante – un ago definito antenna – che induce la rotazione delle molecole di H2O a frequenze di 900-2500 MHz, generando quindi, come per la radio-frequenza, il calore per attrito. L’antenna è lunga nella maggior parte dei casi 10 cm, con diametro di 16-18 G. Non essendo un circuito elettrico chiuso, a differenza della radio-frequenza, non vi è controindicazione per pazienti gravide o portatori di pace-maker. La tecnica utilizzata, chiamata modified multishot technique, segue anch’essa un approccio trans-istmico. L’antenna a micro-onde genera un’area di ablazione di diametro maggiore rispetto alla radio-frequenza. L’antenna viene quindi posizionata in profondità all’interno del nodulo e poi spostata con movimento “a ventaglio”, con un minor numero di riposizionamenti dell’ago. Tale tecnica utilizza aghi di calibro maggiore (16-18 G), che fungono da antenne, e in genere richiede l’incisione della cute. Analogamente a quanto avviene per la RFA, gli aghi vengono introdotti mediante approccio trans-istmico, utile a minimizzare il rischio di esposizione al calore dell’area ricorrenziale, e sono successivamente riposizionati per aumentare il volume di tessuto trattato.
Il costo medio di un generatore di micro-onde varia da 20.000 a 25.000 €, mentre il costo del materiale mono-uso (ago-elettrodo) varia da 900 a 1300 €.

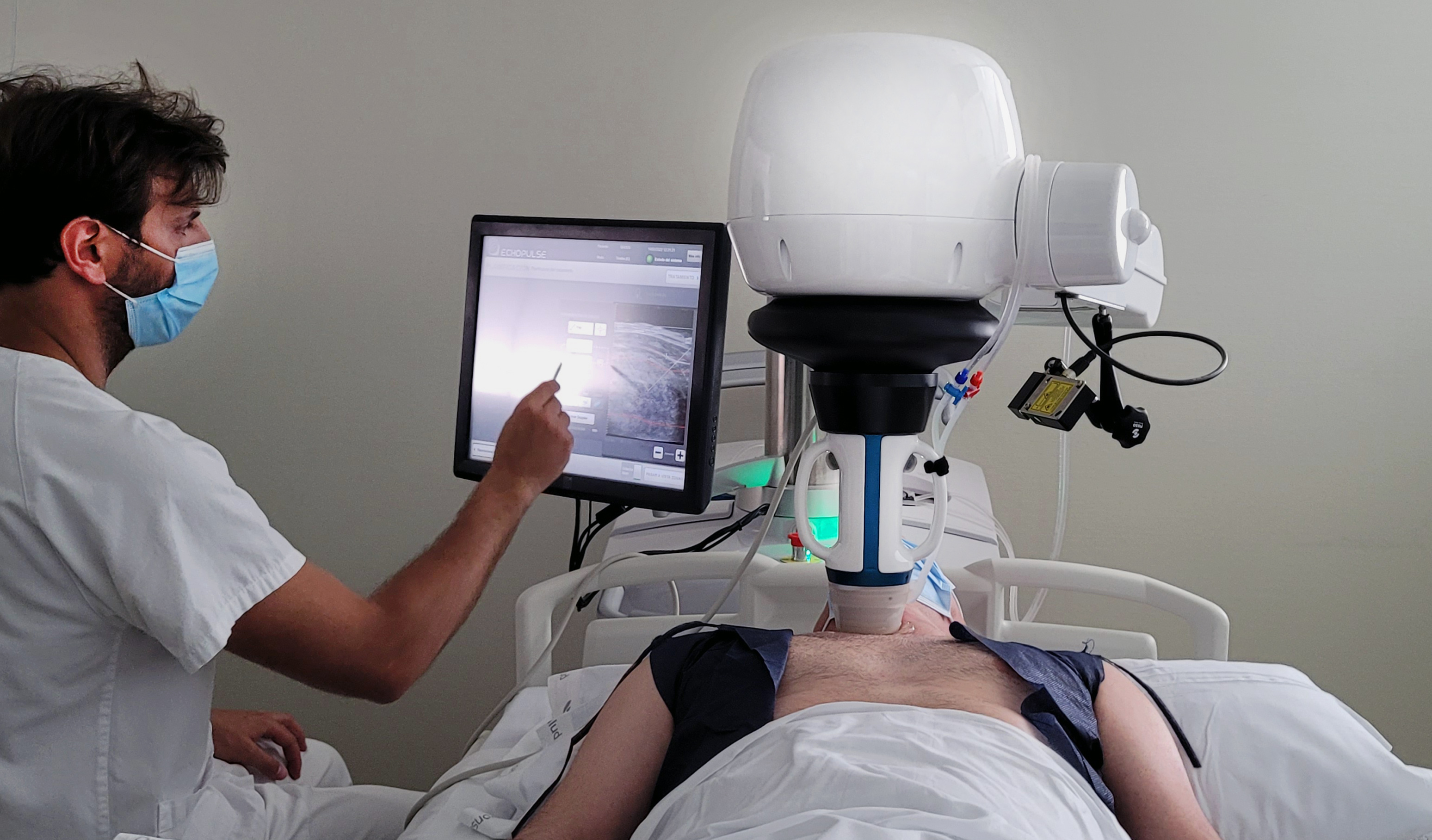
HIFU (High-Intensity Focused Ultrasound)
È l’unica tecnica ablativa completamente non invasiva e che non richiede l’inserimento di aghi attraverso la cute. Concentra ultrasuoni ad alta intensità su una specifica lesione bersaglio, inducendo necrosi coagulativa tramite la combinazione di danno meccanico e termico. L’effetto termico è raggiunto tramite la vibrazione del tessuto che genera, anche in questo caso, calore per frizione.
La procedura è guidata da un computer collegato a un elemento sia emittente che rilevante ultrasuoni e può essere eseguita, tramite uno schermo con funzione touch, da un operatore senza esperienza nell’ambito dell’interventistica tiroidea. L’energia è erogata in più “shot” mirati a coprire piccole frazioni del tessuto bersaglio selezionate mediante mappatura computerizzata. Il costo medio di un generatore di onde HIFU supera i 250.000 €, mentre il kit di materiali mono-uso costa circa 500 €. L’ingresso degli ultrasuoni attraverso la cute deve essere scarsamente collimato, per evitare la formazione di ustioni. Questo aspetto limita l’impiego dell’HIFU nelle lesioni molto superficiali o troppo profonde. Il metodo è costoso e richiede un paziente praticamente immobile per tutta la durata della procedura, che per noduli di media dimensioni – ad esempio 15 mL – può arrivare anche a 20-40 minuti, oltre a una precisa definizione dell’area bersaglio da trattare che escluda le strutture critiche circostanti.
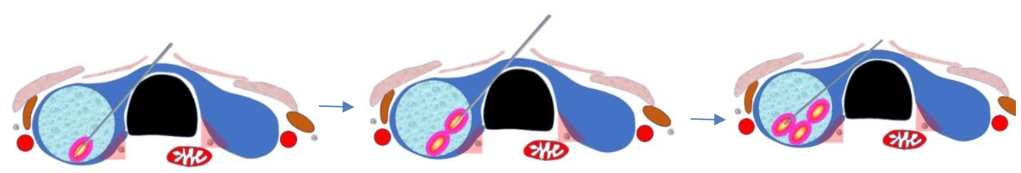
Approccio trans-istmico e moving-shot
Sono aspetti tecnici fondamentali per l’esecuzione dell’ablazione tramite radio-frequenza o micro-onde.
Approccio trans-istmico: inserimento di un ago-elettrodo o antenna tramite l’istmo della tiroide, in direzione mediana-laterale. Tale approccio dà diversi vantaggi:
- l’operatore può monitorare al meglio le posizioni dell’elettrodo, del nodulo bersaglio e del danger triangle;
- il parenchima istmico normale frapposto tra il nodulo bersaglio e il sito di inserimento dell’elettrodo crea un’area di sicurezza fra il bersaglio ablato caldo e l’area peri-tiroidea, riducendo complicanze ed effetti collaterali, quali l’ustione di cute e sottocute o il dolore;
- la posizione dell’elettrodo rimane pressoché stabile anche qualora il paziente parlasse o tossisse.
Tecnica “moving shot”: permette invece l’applicazione dinamica e controllata dell’energia termica. Differentemente dalla termo-ablazione utilizzata in altri organi come il fegato, dove la punta attiva dell’elettrodo resta fissa al centro del tumore bersaglio durante tutta la procedura, nei noduli tiroidei, che sono ellissoidali e spesso esofitici (sporgenti) rispetto alla superficie della ghiandola tiroidea, utilizzare la tecnica fissa potrebbe sotto-trattare o sovra-trattare aree del nodulo e del tessuto circostante. Pertanto, il nodulo tiroideo viene suddiviso in diverse piccole unità di ablazione. Queste unità possono essere poi trattate singolarmente partendo da quelle più profonde, e cioè posizionando l’ago-elettrodo dapprima nella porzione più posteriore del nodulo e poi retraendolo via via (con movimenti definiti “moving shot”), ablando unità per unità, fino alle porzioni più superficiali.
Controlli post-procedurali
La valutazione si concentra sul controllo ecografico post-ablazione, che può essere eseguito dopo 1-24 ore. Nel sospetto di danno al nervo laringeo ricorrente, in seguito alla percezione di voce rauca o bitonale del paziente invitato a parlare, è fondamentale la valutazione foniatrica. Per il controllo del dolore peri- e post-procedurale sono utili FANS e paracetamolo per 24–48 ore. Antibiotici e steroidi non sono raccomandati in maniera routinaria, ma un breve ciclo di cortisone, per os o parenterale, può efficacemente ridurre l’edema dopo l’ablazione.
| Controllo | Finalità e mezzi |
| Ecografia | Verificare area ablata (doppler, CEUS) per eventuali ri-trattamenti. Valutare potenziali effetti avversi precoci. |
| Impacchi con ghiacco | |
| Anti-dolorifici | FANS (sia prima che dopo la procedura). Paracetamolo nelle successive 24-48 h. Non indicati di routine steroidi e antibiotici. |
| Valutazione foniatrica | Se si sospetta danno del nervo ricorrente. |
| Osservazione pre-dimissione | Per 30-60 minuti per valutare eventuali effetti avversi precoci: – dolore grave e in peggioramento; – modificazioni del timbro vocale; – disfagia; – edema o eritema cervicale; – dispnea; – febbre. |
Follow-up
Il beneficio in termini di riduzione volumetrica del nodulo non è immediato. A 24-48 ore dalla procedura può verificarsi un minimo incremento volumetrico del nodulo trattato, dovuto allo sviluppo di una quota infiltrativa-edematosa. Nel corso dei mesi il volume del nodulo si riduce progressivamente, con un sensibile decremento già a tre mesi dalla procedura. La riduzione continua nel tempo, anche nel corso di alcuni anni. La procedura può essere ritenuta di successo se raggiunge una riduzione volumetrica (volume reduction rate, VRR) di almeno il 50%. A prescindere dalla riduzione volumetrica della lesione, la scomparsa dei sintomi compressivi e dei disturbi cosmetici costituisce un possibile parametro di esito della procedura. Fra le misura di efficacia del trattamento, oltre al VRR e al miglioramento dei punteggi sintomatici ed estetici, è appropriato l’impiego di questionari di qualità della vita per pazienti tireopatici, come SF-36 o ThyPro/ThyPro39. Nel corso del follow-up è necessario valutare ogni 6–12 mesi la funzione tiroidea (TSH e FT4). Nel follow-up dei noduli iperfunzionanti sottoposti a termo-ablazione considerare anche l’utilizzo della scintigrafia con 99Tc. Il raggiungimento dell’eutiroidismo o la riduzione del dosaggio dei farmaci anti-tiroidei possono ovviamente essere considerati una misura di efficacia.

Effetti collaterali e complicanze
La complicanza più frequente è la disfunzione laringea, causata dal danneggiamento (transitorio o, più raramente, permanente) del nervo laringeo ricorrente. Il danno porta alla paralisi dei muscoli intrinseci della laringe, eccetto i muscoli crico-tiroidei, con conseguente raucedine e cambiamenti nel timbro vocale. Oltre al danno termico diretto durante la termo-ablazione, altri meccanismi possono contribuire alla sofferenza del nervo ricorrente, manifestandosi nelle ore successive alla procedura: lo “stunning” del nervo dovuto alla lidocaina, il suo stiramento/compressione in seguito alla formazione di un ematoma, l’infiammazione post-emorragica con la fibrosi che si sviluppa intorno al nervo.
Queste complicanze si manifestano in circa il 5% dei pazienti: nella maggior parte dei casi sono transitorie, con recupero spontaneo dopo pochi mesi e senza speciali trattamenti. In caso di noduli che si trovino a ridosso della zona di pericolo, per la protezione del nervo laringeo ricorrente è utile l’idro-dissezione mediante iniezione di destrosio 5% tra la “danger zone” e l’area da trattare, per creare un margine di almeno 5 mm. Per dimostrare l’entità del danno ricorrenziale è necessaria la laringoscopia. Il recupero può essere accelerato da cicli di prednisone e rieducazione foniatrica.
Non vi sono evidenze che la termo-ablazione possa avere un effetto cancerogeno sulla ghiandola tiroidea, come dimostrato dal follow-up a 10 anni dal trattamento.

Risultati e confronti fra le varie tecniche
L’ablazione con radiofrequenza sembra ottenere un tasso di riduzione del volume del nodulo (VRR) significativamente maggiore rispetto all’ablazione laser nei noduli tiroidei benigni non funzionanti. A 12 mesi, il VRR era 70,9 ± 16,9% e 60,0 ± 19,0% rispettivamente nei gruppi radiofrequenza e laser ( P = 0,024). (Cesareo R, Manfrini S, Pasqualini V, et al. Laser Ablation Versus Radiofrequency Ablation for Thyroid Nodules: 12-Month Results of a Randomized Trial (LARA II Study). J Clin Endocrinol Metab. 2021;106(6):1692-1701. doi:10.1210/clinem/dgab102).
L’ablazione con radiofrequenza inoltre ha mostrato un VRR a 12 mesi superiore al trattamento con micro-onde (86,2% contro 80,0%, p = 0,036) (Guo, Dong-Ming et al. “Comparison of radiofrequency ablation and microwave ablation for benign thyroid nodules: A systematic review and meta-analysis.” Clinical endocrinology vol. 95,1 (2021): 187-196. doi:10.1111/cen.14438).
Prospettive future
Il passo successivo sarà l’applicazione di tali tecniche radioablative non solo ai noduli benigni ma anche a quelli maligni con evidenza di tumori piccoli ed in fasi iniziali (microcarcinomi).
Fra le nuove tecniche utilizzabili emerge l’ablazione a Campo Pulsato Nanosecondo (nano-PFA), che utilizza impulsi nanosecondo di energia elettrica per colpire il tessuto cellulare risparmiando le strutture adiacenti.
FONTI
- AME Focus On nr. 5 ottobre 2023 – Termo-ablazione dei noduli tiroidei benigni: la cassetta degli attrezzi per chi deve iniziare
- Papini, E., Monpeyssen, H., Frasoldati, A., & Hegedüs, L. (2020). 2020 European Thyroid Association Clinical Practice Guideline for the Use of Image-Guided Ablation in Benign Thyroid Nodules. European Thyroid Journal, 9(4), 172-185. Retrieved Dec 28, 2023, from https://doi.org/10.1159/000508484
- Kim JH, Baek JH, Lim HK, et al. 2017 Thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol 2018, 19: 632-55
- Jina Kim, Carolyn D Seib, Operative Management of Thyroid Disease in Older Adults, Journal of the Endocrine Society, Volume 7, Issue 7, July 2023, bvad070, https://doi.org/10.1210/jendso/bvad070
- Cesareo R, Manfrini S, Pasqualini V, et al. Laser Ablation Versus Radiofrequency Ablation for Thyroid Nodules: 12-Month Results of a Randomized Trial (LARA II Study). J Clin Endocrinol Metab. 2021;106(6):1692-1701. doi:10.1210/clinem/dgab102
- Guo, Dong-Ming et al. “Comparison of radiofrequency ablation and microwave ablation for benign thyroid nodules: A systematic review and meta-analysis.” Clinical endocrinology vol. 95,1 (2021): 187-196. doi:10.1111/cen.14438
- Sinclair CF, Baek JH, Hands KE, Hodak SP, Huber TC, Hussain I, Lang BH, Noel JE, Papaleontiou M, Patel KN, Russ G, Russell J, Spiezia S, Kuo JH. General Principles for the Safe Performance, Training, and Adoption of Ablation Techniques for Benign Thyroid Nodules: An American Thyroid Association Statement. Thyroid. 2023 Oct;33(10):1150-1170. doi: 10.1089/thy.2023.0281. Epub 2023 Sep 14. PMID: 37642289; PMCID: PMC10611977.
Lascia un commento