L’ormone che non ci fa disidratare

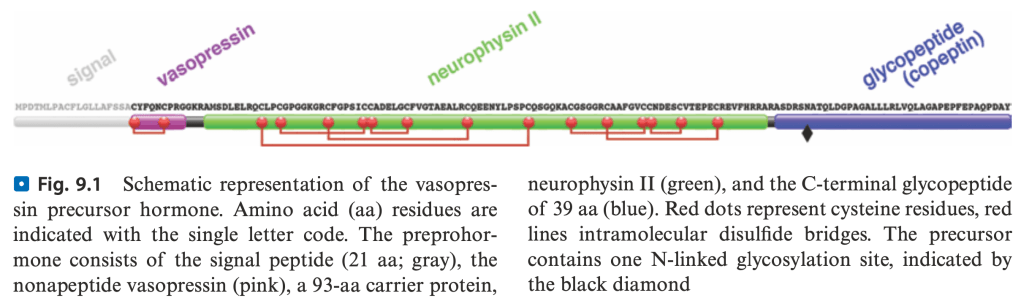
L’arginin-vasopressina (AVP) o ormone anti-diuretico (ADH) è il principale determinante del riassorbimento di acqua libera da parte del rene. È un peptide di nove aminoacidi, sintetizzato come pro-ormone dai nuclei sopraottico e paraventricolare dell’ipotalamo. Pro-AVP entra all’interno di granuli neurosecretori e viene trasportato lungo il peduncolo ipofisario nella neuroipofisi, dove i granuli vengono accumulati nel citoplasma. Durante il trasporto, il pro-ormone viene trasformato nel nonapeptide AVP, nella proteina trasportatrice neurofisina II (NPII), e in un glicopeptide C-terminale chiamato copeptina.
I granuli contenenti ADH stipati nel citoplasma delle cellule neuroipofisarie riversano il loro contenuto nel torrente circolatorio in seguito a stimoli specifici. I principali sono l’iperosmolarità e l’ipovolemia. Stimoli non specifici includono dolore, situazioni di stress (ad esempio malattia acuta o un’operazione) o nausea.
L’attività antidiuretica si esercita nel rene a livello del tubulo contorto distale e del dotto collettore midollare, dove l’ormone si lega ai recettori V2 (arginine vasopres- sin receptor 2, AVPR2) e, mediante l’inserzione di un particolare canale dell’acqua (acquaporina-2) alla membrana apicale delle cellule principali, determina un’aumentata permeabilità all’acqua del dotto collettore, con conseguente riduzione del flusso urinario e incremento dell’osmolalità urinaria. A seconda della presenza di ADH in circolo, l’urina sarà più concentrata (fino a 1200 mOsm/L) se l’ormone è alto; o diluita se ADH non viene prodotto (fino a 50 mOsm/L). L’ADH in condizione sovrafisiologiche può legare il recettore V1a e dare costrizione (ecco perché si usa nello shock settico), come accade nella risposta all’ipotensione grave. Può stimolare anche la liberazione di ACTH e GH (recettore V1b).
La liberazione di ADH dipende da vari stimoli:
- Regolazione osmotica: principale stimolo fisiologico alla liberazione nella circolazione sanguigna di AVP è l’aumento dell’osmolalità plasmatica, mediato dagli osmorecettori situati nell’ipotalamo anteriore: sopra la soglia di 280 mOsm/Kg H2O (l’equivalente di >135 mEq/L di concentrazione plasmatica di Na), esiste una relazione lineare tra osmolalità plasmatica e concentrazione ematica di AVP. Quando l’osmolalità diventa <275 mOsm/kg invece il rilascio di AVP cessa.
- Regolazione del volume circolante e della pressione arteriosa: al secondo posto nella scala gerarchica degli stimoli capaci di immettere in circolo AVP ci sono l’ipovolemia e la riduzione della pressione ematica. In realtà, entrambi questi stimoli di volume sono di gran lunga meno potenti dello stimolo osmotico. Secondo alcuni studi, ad esempio, pare che solamente perdite cospicue del volume del liquidro extra-cellulare – LEC – (> 8-10%) siano in grado di aumentare direttamente la secrezione di AVP, mentre deplezioni di volume extra-cellulare più modeste agiscano indirettamente, amplificando la sensibilità a secernere AVP in risposta all’aumento dell’osmolalità plasmatica. Ne consegue che, a parità d’incremento dell’osmolalità plasmatica, la quantità di AVP immessa in circolo aumenterà in maniera ancor più consistente se il paziente è anche lievemente ipovolemico.
- Farmaci: nicotina, morfina, vincristina, ciclofosfamide, clofibrato, clorpropramide, alcuni antiepilettici (carbamazepina), alcuni antidepressivi triciclici, stimolano la liberazione di ADH. Etanolo, naloxone, difenildantoina, clorpromazina inibiscono la liberazione di ADH e incrementano la diuresi.
- Nausea: tra gli altri stimoli non osmotici in grado di stimolare la secrezione di AVP, una menzione particolare merita la nausea, che probabilmente è, in generale, ancor più potente dello stimolo osmotico nell’attivare la secrezione di AVP.
- Altri: ipogliciemia acuta, deficit di glucocorticoidi, tabagismo e iperangiotensinismo stimolano la liberazione di ADH.
La sete, similmente alla secrezione di AVP, è stimolata soprattutto dall’aumento dell’osmolalità plasmatica, espressione biochimica di disidratazione intracellulare. Tuttavia, la soglia oltre la quale l’osmolalità plasmatica innesca la sensazione della sete (287-295 mOsm/Kg H2O, secondo alcuni studi non più recenti) è superiore a quella che determina la secrezione di AVP. In termini finalistici, la sete interviene quando la secrezione di AVP inizia a mostrare qualche oggettiva difficoltà nel produrre un’ulteriore riduzione del flusso urinario associato al relativo incremento dell’osmolalità urinaria, che nell’uomo non riesce a superare le 1200 mOsm/Kg H2O. La riduzione del volume del LEC e della pressione ematica sono gli stimoli non osmotici in grado di stimolare la sensazione della sete. Tuttavia, nei Primati solamente l’ipovolemia e/o l’ipotensione arteriosa di una certa entità stimolano la sete, probabilmente quale conseguenza dell’acquisizione della postura eretta. La sete rappresenta certamente un meccanismo omeostatico di rilevante importanza in condizioni patologiche che determinano disidratazione cellulare, con incremento dell’osmolalità plasmatica, o deplezione consistente del volume del LEC (emorragie cospicue, diarrea profusa, ecc). Tuttavia, non sembra intervenire nella fine regolazione giornaliera dell’osmolalità plasmatica, che solitamente oscilla di 1-2 mOsm/Kg H2O. L’introduzione di liquidi nell’uomo, peraltro, è spesso espressione di abitudini individuali o di gruppo (introito non controllato da meccanismi di omeostasi) piuttosto che la conseguenza di una reale sensazione di sete. Ne consegue che in condizioni fisiologiche l’omeostasi dell’acqua è mantenuta soprattutto grazie al controllo dell’eliminazione di acqua libera mediato dalla secrezione di AVP, mentre la sete compare solamente quando iniziano a manifestarsi segnali di disidratazione cellulare o di deplezione di volume del LEC.
Dosaggio plasmatico dell’AVP vs copeptina nel diabete insipido
Per la diagnosi di deficit di arginin-vasopressina (ex diabete insipido centrale) il dosaggio dell’AVP circolante si è dimostrato non affidabile per limiti pre-analitici e analitici, con un’accuratezza diagnostica del solo 46%. Tale inefficienza ha reso necessaria la ricerca di nuovi analiti in grado di riflettere i livelli di AVP circolanti. In quest’ottica, un ottimo surrogato è la copeptina, prodotto di clivaggio biologicamente inerte della molecola precursore dell’AVP. È secreta dalla neuro-ipofisi in risposta a stimoli osmotici e barocettoriali in quantità equi-molari rispetto all’AVP. La copeptina è un prodotto stabile, che non necessita di procedure di estrazione ed è facilmente rilevata dalle comuni metodiche immunometriche di dosaggio.
Valori basali di copeptina >21.4 pmol/L sono diagnostici per diabete insipido nefrogenico.
Alcuni autori popongono il dosaggio della copeptina 60 minuti dopo l’infusione parenterale di arginina, con cut-off diagnostico pari a 3.8 pmol/L per distinguere tra deficit di arginin-vasopressina centrale e polidispsia primaria, con accuratezza del 93%. Questo test rappresenta un’interessante alternativa ai comuni test dinamici, ben tollerata e sicura, ma necessita di validazione e definizione di cut-off diagnostici centro-specifici.
Dosaggio plasmatico dell’AVP vs copeptina nella SIAD
Le attuali linee guida non raccomandano la misurazione dell’AVP nel plasma per confermare la diagnosi di SIAD (sindrome da inappropriata antidiuresi). L’AVP è molto difficile da misurare principalmente a causa di problemi preanalitici e analitici. Secondo un ampio studio prospettico con misurazioni della copeptina, livelli chiaramente elevati di copeptina indicavano iponatriemia ipovolemica (specificità 90%, sensibilità 23%), mentre livelli bassi indicavano polidipsia primaria (specificità 91%, sensibilità 58%). Tuttavia, la concentrazione sierica di copeptina non è stata utile per distinguere tra SIAD e altre cause di iponatriemia. Pertanto, l’ampio utilizzo della copeptina come marcatore diagnostico nell’iponatriemia non può ancora essere raccomandato. L’osmolalità urinaria è generalmente un indicatore surrogato abbastanza buono dell’attività dell’AVP (a condizione che la funzione renale non sia marcatamente compromessa) che è più facilmente accessibile: una bassa osmolalità urinaria è spesso sufficiente a porre il sospetto di diagnosi differenziali come polidipsia o basso apporto di soluti.
È stato dimostrato che l’iponatriemia dovuta a polidipsia primaria, o ad un’assunzione estremamente bassa di soluti che riduce la capacità escretrice di acqua priva di elettroliti, mostra un basso livello di copeptina, riflettendo la fisiopatologia AVP-indipendente. La SIAD nefrogenica, causata da una mutazione attivante nel recettore V2 della vasopressina, porta anche alla soppressione dell’AVP e della copeptina. L’identificazione di questa rara differenza può essere un’eccezione in cui il test della copeptina nell’iponatriemia potrebbe essere utile: un risultato basso di copeptina (senza evidenza di polidipsia) può essere seguito da un test di conferma del gene AVPR2.
Lascia un commento